Funkcionális virológia
A vírusok gyenge pontjainak megtalálásához, és a velük szembeni hatékonyabb küzdelemhez új megközelítésekre, valamint az éppen aktuális paradigmák felülvizsgálatára van szükség az újabb ismeretek tükrében. A fenti állítással összhangban csoportunk a vírus életciklusok molekuláris szabályozásának olyan kevéssé vagy egyáltalán nem tanulmányozott aspektusait vizsgálja, amelyek hatékonyabb stratégiák és eszközök kifejlesztéséhez vezethetnek gazdaságilag jelentős víruspatogének ellen.
Afrikai sertéspestis kutatás
Az afrikai sertéspestis (ASP) vérzéses, lázas tünetekkel járó megbetegedés, a fertőzés akár a megfertőződött állatok 100%-os elhullásához is vezethet. Magyarországi, 2018-as megjelenése óta eddig közel 5000 elhullott vagy kilőtt vaddisznónál azonosították a vírust
A vírus elleni védekezést nagymértékben megnehezíti, hogy az ASFV környezeti hatásokkal szemben rendkívüli ellenálló, továbbá az is, hogy a számtalan elsőre ígéretesnek tűnő vakcinajelölt egyike sem váltotta be a hozzáfűzött reményeket, és jelenleg nem rendelkezünk ellene hatékony védőoltással. A fejlesztéseket jelentősen hátráltatja, hogy a vírus teljes életciklusa és a 200 kbp genom kódolta fehérjék jelentős részének funkciója ismeretlen. A hatékony vakcinafejlesztés elengedhetetlen lépés a járvány legyőzéséhez, amelyhez nélkülözhetetlen a vírus célzott genetikai manipulációja.
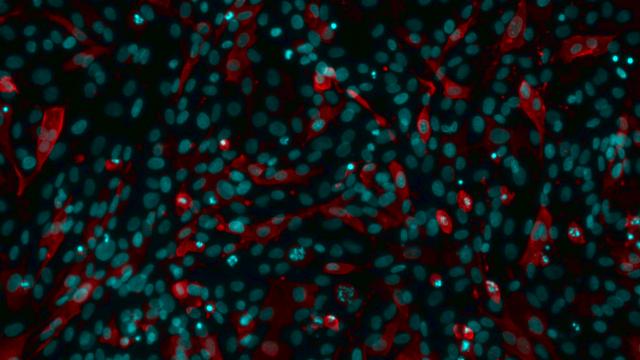
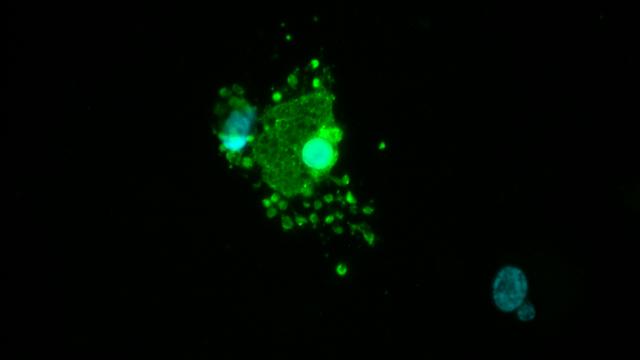
Kutatócsoportunk olyan hatékony CRISPR/Cas9 alapú rendszer kifejlesztésén dolgozik, amellyel rutinszerűen módosítható az ASPV genom bármely génje. A rendszer elősegítheti az eddig ismeretlen funkciójú gének megismerését, továbbá áttörést jelenthet a vakcinafejlesztés tekintetében is. Az ASP vizsgálatához mindenképpen hasznos lenne egy, az in vivo fertőzéshez a lehető legközelebb álló, megbízhatóan reprodukálható kísérleti rendszer felállítása, ezért munkánk során szövettenyészetben illetve primer makrofágokban tanulmányozzuk az ASPV szaporíthatóságát.
Parvovírus kutatás
A sertésparvovírus (PPV) a súlyos gazdasági károk okozására képes, koraszüléssel, vetéléssel, infertilitással járó SMEDI tünetegyüttes kórokozója.
Az ezredforduló után több tanulmány is publikálásra került, melyek olyan új magasabb patogenitással rendelkező PPV törzsek (ún. 27a-szerű törzsek) megjelenéséről tudósítanak, amelyek ellen a forgalomban lévő vakcinák nem, vagy gyengébb védelmet nyújtanak. Kutatócsoportunk évek óta kiemelt figyelmet fordít ezekre a potenciálisan magasabb patogenitású törzsekre.
Kidolgoztunk egy olyan, PCR-en alapúló diagnosztikai eljárást, amely képes szelektíven kimutatni a 27a-szerű törzseket, és elkülöníteni őket a többi PPV törzstől. Részt vettünk egy új, a 27a-szerű törzsek ellen is megfelelő immunválaszt kiváltani képes védőoltás fejlesztésének klinikai fázisában. Különböző sejtvonalakon vizsgáltuk számos PPV törzs in vitro fertőzőképességét.
Jelenleg is vizsgáljuk az immunizált állatokban termelődött ellenanyagok 27a törzs elleni neutralizációs képességét azért, hogy pontos adatokat nyerjünk a forgalomban lévő vakcinák hatásosságára vonatkozóan. Célunk a 27a törzs eltérő biológia tulajdonságaiért felelős kulcsmutációk azonosítása, valamint egy olyan szerológiai teszt kifejlesztése, amely a PPV törzsek in vitro fertőzőképességének különbségei ellenére gyorsan és megbízhatóan képes meghatározni a termelődött ellenanyagok neutralizációs képességét.
Sertés légzőszervi és reprodukciós szindróma vírus (PRRSV)
Hazánkban a sertés reprodukciós zavarokkal és légzőszervi tünetekkel járó szindrómát (PRRS) 1995-ben azonosították először. A betegség kórokozója egy a Nidovirales renden belül az Arteriviridae családba tartozó, pozitív egyszálú RNS-genommal rendelkező burkos vírus. Két vírust azonosítottak, amely a kórképet okozza: a PRRSV1-t, korábbi néven 1-es vagy európai genotípust, illetve a PRRSV2-t, más néven 2-es vagy amerikai típust. A két vírus nukleotidszinten mindössze kb. 60% hasonlóságot mutat egymással. A PRRSV2 főleg Észak-Amerikában okoz megbetegedést, de jelenlétét hazánkban is kimutatták.
A betegségre jellemző a légzőszervi károsodás miatt a fiatalabb állatokban a fülön megjelenő cianózis, amely mellé testtömegvesztés és a növekedés lelassulása is társul. A kocáknál a fertőzés megnövekedett arányú koraellést és vetélést okoz. A komoly gazdasági károk következtében Magyarországon 2010-ben bejelentésre került a Nemzeti PRRS Mentesítési Program, amelynek célja, hogy hazánkat 2022-re mentessé tegye a betegségtől.
Kutatócsoportunk fő témája a magyarországi PRRSV törzsek genetikai diverzitásának térben és időben történő felmérése és a különböző PRRSV törzsek mutációs rátáinak összehasonlítása.
Influenzavírus kutatás
Az influenza A vírus (IAV) széles gazdaspektrummal jellemezhető, mely kiterjed a különböző madár és emlősfajokra, és amelyben a víziszárnyasok testesítik meg a kórokozó fő fenntartóját. A vírus járványtani fontossága abból a képességéből ered, hogy képes alkalmazkodni gazdafajok széles köréhez (köztük emberhez) és bennük akár halálos kimenetelű betegséget is kialakítani. A 2017-es magas patogenitású madárinfluenza (HPAI) járvány csak Magyarországon hét milliárd forintos kárt okozott, és közel két millió állatot kellett miatta leölni. A nagy gazdasági kértétel ellenére ellentmondásosak az ismereteink arról, hogy melyik gazdában alakulnak ki a HPAI vírusok. Ugyan több esetben kimutatták már ezek baromfiban történő kifejlődését alacsony patogenitású madárinfluenza (LPAI) törzsekből, ugyanakkor közvetlenül rájuk bukkantak már vadmadarakban is. Vizsgálataink további információkat szolgáltathatnak a HPAI vírusok kialakulásáról, és segítségükkel meghatározhatjuk, hogy ezek a vírustörzsek a baromfikban keletkeznek-e új mutációk révén, vagy közvetlenül víziszárnyasokból származnak.
A NEG8 fehérje általánosan előfordul IAV-okban, a vírus életciklusában betöltött szerepe jelenleg mégis ismeretlen. Ugyan lehetséges, hogy madarakban szerepe van a magas patogenitású törzsek kialakulásában, a sejten belüli lokalizációjáról és funkciójáról rendelkezésre álló hiányos ismereteink mégis kizárólag emlős sejtekben végzett kísérleteken alapulnak. A kutatásaink során vizsgáljuk a NEG8 fehérje funkcióját madár eredetű sejtekben. Reményeink szerint eredményeink alkalmazhatóak lesznek a humán IAV-k kutatásában is.
Hazai és külföldi együttműködéseink
Nápolyi Federico II Egyetem – Adeno-asszociált vírus kutatás
Az együttműködés keretein belül a nápolyi Federico II Egyetemmel kollaborálva sertés fajokból származó adeno-asszociált vírusok (AAV) génterápiában való alkalmazásának lehetőségeit vizsgáljuk. Az együttműködés során a sertés AAV-k monitorozásán túl részt veszünk a genetikai szembetegségek kezelésére használatos AAV alapú vektorrendszerek hatásosabbá tételében.
Ceva-Phylaxia Oltóanyagtermelő Zrt. – Sertésparvovírus és cirkovírus kutatás
A Ceva-Phylaxia Oltóanyagtermelő Zrt-vel együttműködve célunk a sertéságazatot érintő legnagyobb gazdasági és állategészségügyi kártétellel járó kórokozók elleni védekezésben való részvétel. A sertés cirkovírus-2-vel (PCV2) és a sertés parvovírusokkal (PPV) kapcsolatban a legnagyobb tudományos kihívást az jelenti, hogy az elérhető vakcinák hatékonysága változhat az újabb és újabb geno- és szerotípusok megjelenésével. Az együttműködések során olyan különböző új geno- és szerotípusokat megkülönböztetni képes diagnosztikai módszereket fejlesztünk, melyekkel a különböző haszonállat parvo- és cirkovírusok immunválaszt elkerülő geno/szerotípus változatai idejekorán azonosíthatók.